La química orgánica es una rama de la química que estudia las sustancias y compuestos de tipo orgánico; o sea, aquellos que contienen en su estructura atómica el carbono. Por esa razón, esta disciplina también es conocida como la “química del carbono”.
No obstante, los químicos modernos han ampliado su campo de estudio. Aunque el alma de la química orgánica sigue siendo el carbono, también se consideran compuestos orgánicos aquellos que contengan hidrógeno, azufre, oxígeno, nitrógeno y halógenos, los cuales aparecen con frecuencia en los organismos vivos y sus compuestos derivados.
La química orgánica se interesa en general por la estructura, el comportamiento, las propiedades y los usos de esos compuestos químicos, por lo que es esencial para comprender cómo funciona la vida en nuestro planeta.
La principal diferencia entre química orgánica e inorgánica radica precisamente en los elementos que estudian. Mientras que la química orgánica analiza los compuestos del carbono y sus derivados, la química inorgánica se enfoca en la composición, estructura interna y reacciones de los compuestos químicos inorgánicos, como los óxidos, hidróxidos, ácidos o sales.
El sector industrial de la química orgánica es probablemente uno de los que más ha crecido en las últimas décadas, en gran parte debido a su diversidad y la cantidad de recursos que produce para otras industrias, por lo que desempeña un papel protagónico en la economía mundial. Hoy, la química orgánica está presente en los procesos a través de los cuales se obtienen el petróleo, la gasolina, el gas natural o el butano, combustibles esenciales para el funcionamiento de la industria y los hogares.
La química orgánica también se encuentra en la base de los procesos de fermentación y destilación de azúcares que se llevan a cabo por microorganismos y se utilizan tanto en la industria alimentaria para elaborar alimentos como en el sector cosmético para fabricar solventes. De hecho, es esencial para la fabricación del jabón a partir de las grasas animales y vegetales.
No obstante, la química orgánica no solo se encuentra en la base de muchos procesos industriales, también es esencial en el campo médico, donde se utiliza fundamentalmente para identificar, sintetizar y desarrollar nuevos compuestos químicos aptos para el uso terapéutico, desde los antibióticos hasta sustancias que imitan la función de las hormonas y enzimas, por lo que también es vital para nuestra salud.
Hoy por hoy, la importancia de la química orgánica es tal, que forma parte del currículo de una amplia gama de carreras, desde la Biotecnología hasta la Bioquímica, Farmacia, la Medicina o la Ingeniería Ambiental.
https://universidadeuropea.com/blog/que-es-quimica-organica



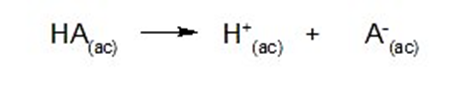
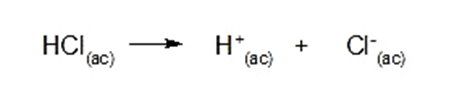
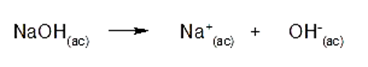
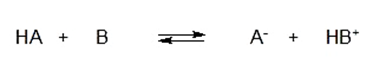
![K=\frac{[C]^c[D]^d}{[A]^a[B]^b}](https://www.quimica.es/enciclopedia/images/math/c/3/7/c37c055a41f1d4c179787ca8522117dd.png)



